D-25/0030 – Février 2025

Gilead s’engage dans la lutte contre le cancer via la mise à disposition de traitements innovants et le soutien d’actions de sensibilisation, de prévention et d’accompagnement à la fois des patients, de leurs proches et des soignants.

OPTIMISATION DU PARCOURS DE SOINS EN ONCO-SÉNOLOGIE
Parce que les parcours de soins s’inscrivent dans des parcours de vie, Gilead Oncology met à disposition des professionnels de santé et des patients, des outils et services pour optimiser et fluidifier la prise en charge.



Le cancer du sein est une maladie hautement hétérogène, ces différences ont servi de base à la classification des types et sous-types de ce cancer. On distingue plusieurs types d’hétérogénéité(3).
L’hétérogénéité tumorale peut être temporelle ou spatiale(4).
L’hétérogénéité temporelle est observée en cas d’évolution d’une tumeur primitive vers un stade métastatique ou au sein de différentes métastases. L’hétérogénéité tumorale temporelle la plus documentée concerne la discordance d’expression des récepteurs hormonaux (estrogènes et progestérone) et d’HER2 entre la tumeur primitive et les lésions métastatiques(3).
Les taux de discordance rapportés sont les suivants(3) :
pour les récepteurs hormonaux aux œstrogènes
pour les récepteurs à la progestérone
pour l’amplification d’HER2
Ces modifications peuvent faire évoluer le comportement tumoral impliquant des conséquences cliniques.
Par exemple, l’évolution de RH+/HER2− vers RH−/HER2− dégrade le pronostic des patientes(3).
Chez les patientes atteintes d’un cancer du sein métastatique, nouvellement diagnostiquées ou en rechute, une biopsie (si elle est techniquement réalisable) devrait être réalisée. L’objectif est de confirmer l’analyse histologique et de réévaluer la présence des récepteurs hormonaux (œstrogène et progestérone) ainsi que des récepteurs HER2(5).
L’hétérogénéité spatiale est moins documentée. Elle s’observe notamment en cas de multifocalité.
Elle désigne la coexistence de sous-populations cellulaires(4).
Les anticorps drogue-conjugués (ADC) associent un anticorps ciblant un récepteur membranaire de la cellule tumorale, et un agent cytotoxique reliés par un linker(6). L’intérêt de ces thérapies ciblées est d’optimiser la délivrance d’une chimiothérapie dans des lignes cellulaires tumorales identifiées par un marqueur(6).
La prise en charge des patientes par ces agents thérapeutiques implique une prise en compte de l’hétérogénéité intratumorale de l’antigène cible et des évolutions de cet antigène sous la pression des traitements et de l’évolution de la pathologie.(6)
Les ADC impliquent une surveillance et une gestion des toxicités(7).
A terme, différentes chimiothérapies ou autres traitements du cancer pourront être administrés par vectorisation d’anticorps(6).
Professeur d’Oncologie Médicale à l’Université de la Sorbonne et Praticien Hospitalier au Département d’oncologie médicale de l’hôpital Tenon, Paris (AP-HP)
Dans le cancer du sein triple négatif (CSTN), la survie globale médiane au diagnostic métastatique est de 14,5 mois et le taux de survie à 5 ans est de 11,3%(8). Dans cette pathologie, le besoin médical reste important(9). Ce type de cancer du sein implique une prise en charge complexe(10).
Une absence d’expression en
immunohistochimie
des récepteurs hormonaux
(< 10 % des cellules exprimant RE et RP)(8,11)
Une absence de surexpression des récepteurs HER2/Absence d’amplification du gène HER2/neu(12)
Environ 9 000 femmes sont concernées chaque année par un cancer du sein
triple négatif(13).
Ces patientes sont souvent plus jeunes que les femmes atteintes
d’autres sous types de cancer du sein(9).
En effet, parmi les femmes diagnostiquées d’une tumeur primitive, 50 % ont moins de
53 ans et 25 %
sont âgées de moins de 43 ans(9).
de CSTN(11). Il s’agit du pourcentage qu’ils représentent parmi
les
66 860 nouveaux cas annuels de cancer du sein, en France(1)

des femmes diagnostiquées ont moins de 53 ans(9)

ont moins de 40 ans lors du diagnostic(13)
Cette pathologie agressive est associée à un risque de rechute important(9). En effet, le risque de récidive à distance dans les 3 ans après le diagnostic est plus important dans ce sous-groupe de cancer du sein(14). Près de 30% des patientes diagnostiquées à un stade précoce développeront des métastases(15).

* Données 2018
Les rechutes métastatiques concernent donc également des populations jeunes.
Au
diagnostic de rechute métastatique, l’âge médian des patientes est de 56 ans, 22 % ont moins de 45 ans.
De plus,
28% des CSTN sont diagnostiqués d’emblée à un stade métastatique(9).
Le cancer du sein triple négatif est associé à un pronostic défavorable :
52,3 % des rechutes sont précoces et associées au pronostic le plus péjoratif(9).
Dans la cohorte française ESME (épidémiologie et stratégie médico-économique), en L1 métastatique, les médianes de survie sans progression et de survie globale sont respectivement de 4,8 mois (IC95 % : 4,6-5,1) et 14,8 mois (IC95 % : 14,1-15,5)(9). L’accès aux lignes de traitements ultérieures est limité : 61 % des femmes qui bénéficient d’une 1re ligne de traitement accèdent à une deuxième ligne de traitement, 37 % à une 3e ligne et seulement 20 % à une 4e ligne(16).
Contrairement aux autres sous-types de cancer du sein, la survie globale n’a pas évolué au cours de ces
15 dernières années chez les femmes atteintes d’un cancer du sein triple négatif. De manière générale, la survie globale médiane au diagnostic métastatique est de seulement 14,5 mois, et le taux de survie à 5 ans de 11,3 %(8).
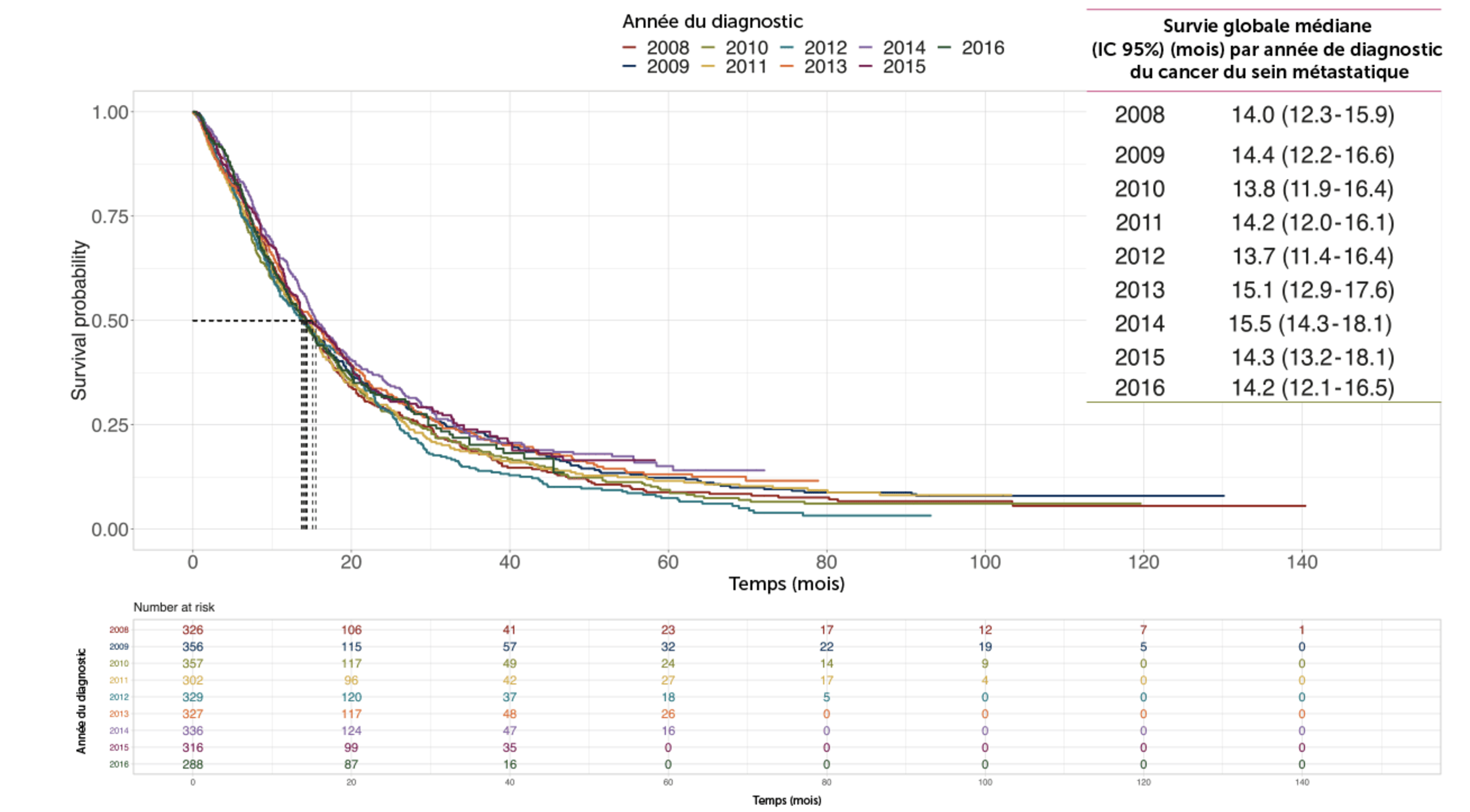
* Données issues de la cohorte française ESME(9,16) (Épidémiologie et Stratégie Médico-Économique) : données de vie réelle recueillies chez 22 109 patientes ≥ 18 ans atteintes d’un cancer du sein métastatique nouvellement diagnostiqué et dont le traitement a été initié entre janvier 2008 et décembre 2016 dans l’un des 18 centres français de lutte contre le cancer. Parmi ces cancers, environ 15% (13,4 %, n = 2 963) étaient triple négatifs.
La présence de l’expression des récepteurs aux œstrogènes et à la progestérone.
L’absence d’amplification
du gène HER2.(19)
RO ou RP sont considérés
positifs à partir de 10%
d’expression.(18)

RO, récepteurs aux œstrogènes ; RP, récepteurs à la progestérone ; HER2, récepteur 2 du facteur de croissance épidermique humain ; Pi3K/AKT, phosphoinositide-3-kinase–protéine kinase B

de survie relative à 5 ans au stade invasif non métastatique.$

Est l'âge médian au diagnostic de la tumeur primaire.(9)

Est l'âge médian au diagnostic des métastases.(9)
$Données de 23 703 cancers du sein invasif non-métastatique issues du registre français d’Isère(21) collectés entre 1990 et 2018. A partir de 2011, les données de 8 123 patientes ≥ 20 ans avaient l’information du sous-type de tumeur, environ 75% (n= 6 076) étaient RH+ HER2-.
Dans le cancer du sein RH+/HER2-, la survie sans progression et de survie globale médiane au diagnostic métastatique sont respectivement de 10,7 (IC95 % 10,5 - 11) et 43,3 mois (IC95 % 42,5 – 44,5) (9)**. Dans cette pathologie au stade précoce, il existe un fort taux de guérison cependant au stade métastatique le pronostic est limité (34% de survie relative à 5 ans(20)).
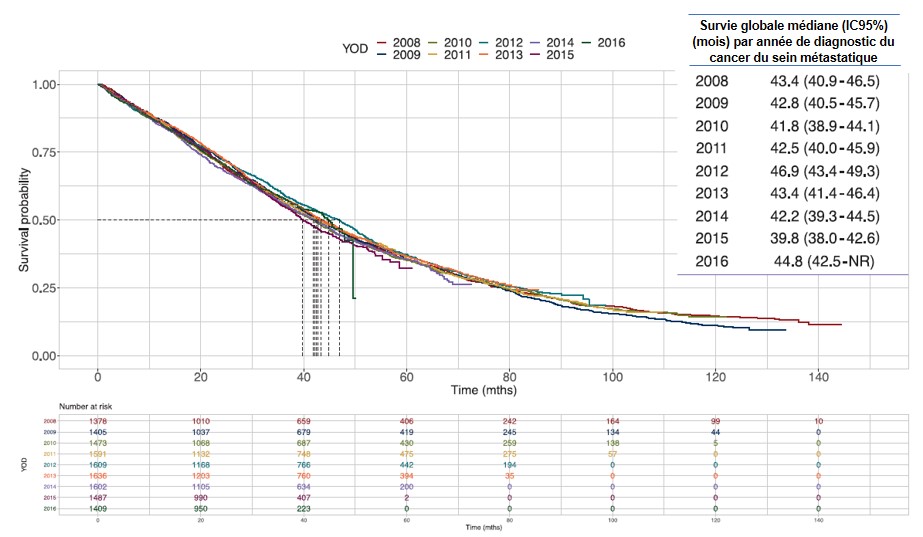
**Données de la cohorte française ESME (8,9,16,23) (Épidémiologie et Stratégie Médico-Économique) d'Unicancer, un registre national qui recueille les données de tous les patients traités consécutivement pour un cancer du sein métastatique dans 18 centres de cancérologie en France, entre le 1er janvier 2008 et le 31 décembre 2016. Cette cohorte est ainsi unique, à grande échelle et en vie réelle.
20 à 30% des patientes au stade localisé récidivent sur le plan locorégional ou à distance(22).
Plus de 50% des métastases sont osseuses(23).
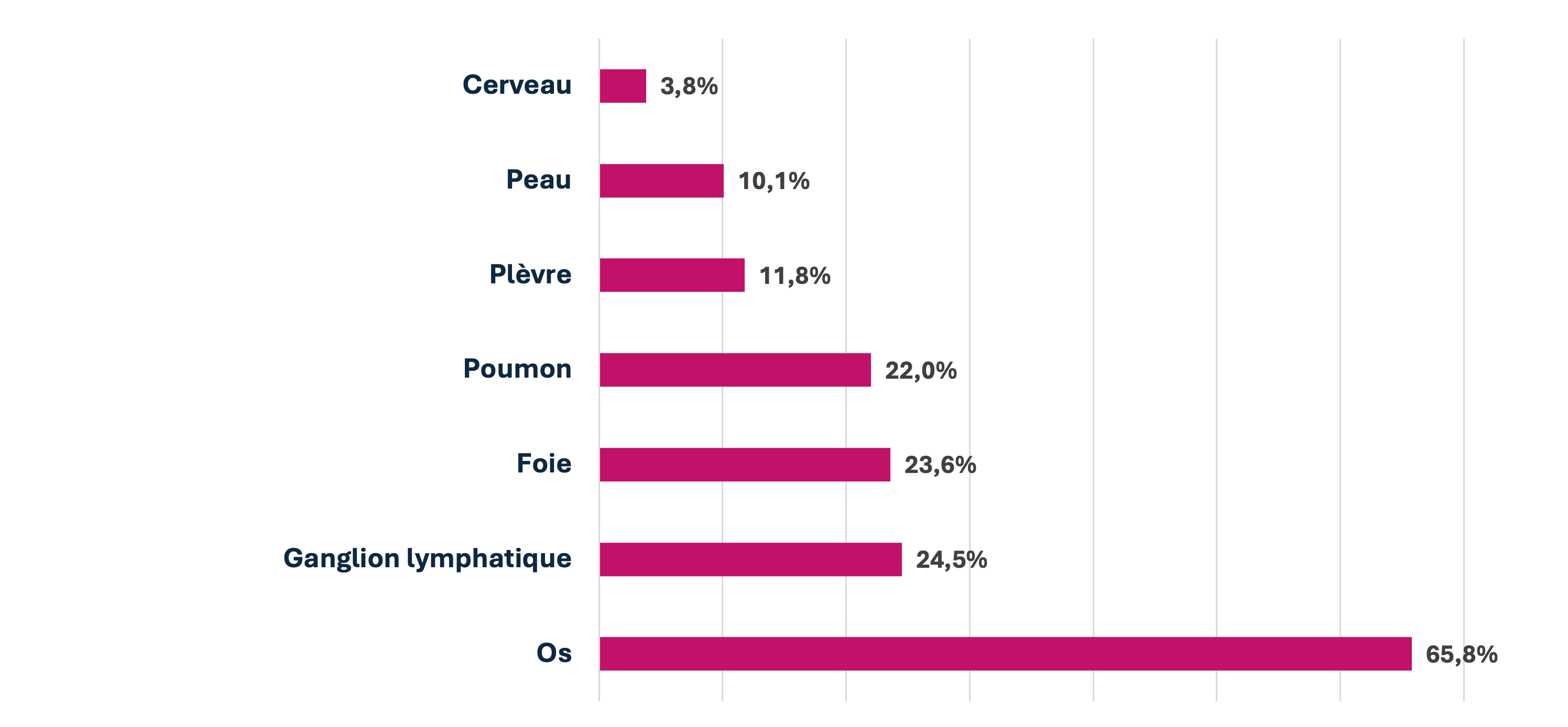
Il reste un réel besoin médical non couvert en particulier au stade métastatique.
Cependant, de nouveaux traitements émergent et permettent d’apporter un bénéfice clinique(24).
D-25/0030 – Février 2025